微生物是涵盖细菌、病毒、真菌以及一些小型的原生生物、显微藻类等在内的一大类生物群体,它个体微小,与人类关系密切。人类对微生物的利用甚早,它们被广泛应用来生产白酒、奶酪、面包、泡菜、啤酒和葡萄酒。随着对微生物认识的深入,它们还在农业、医药、环保等各个领域发挥着巨大作用。但是,你有没有想过,小小微生物,就像一个复杂的化学品加工厂,在体内执行着成百上千的代谢反应,推动着自身生命过程的正常运转。如果我们能够利用这些代谢反应,合理的规划出目的产品的生产流程,就可以生产各种各样的化学品了。
生物乙醇
在生活中,我们很早就已经发现了能将各种生物质发酵转化为乙醇的微生物。其发酵得到的生物乙醇作为燃料酒精已经在各个国家得到了广泛关注。与传统能源相比,生物乙醇无毒无害,且其生产原料- 生物质存量丰富,仅以木质纤维素为例,据统计每年通过光合作用合成的木质纤维素达2×1011t,通过光合作用固定的太阳能4×1021J。如果算上玉米、甘蔗等作物,其原料来源则更为客观。第一代生物乙醇的制备主要以玉米、甘蔗为原料,工艺较为简单,使其产量迅速上升。但由于存在着与人争粮的问题,第一代制备技术无法大规模的推广。因此,以木质纤维素为原料的第二代生物乙醇制备技术得到了科学家们广泛的关注。由于木质纤维素复杂的结构,除需要严格的预处理技术之外,发酵工程中所用菌株的性质也对发酵效率有着重要的影响。目前对于利用木质纤维素生产乙醇的菌种研究主要集中于酿酒酵母、运动发酵单胞菌、大肠杆菌和克雷伯氏杆菌等。前两者能够高效地利用葡萄糖发酵得到乙醇,但却不能发酵大量存在于纤维素水解物中的五碳糖(尤其是木糖);后两者具有较宽的底物谱,但乙醇并不是它们的主要代谢产物。因此,科学家们正在采用基因工程的手段尝试在菌株中加入新的代谢通路,以期搭建新的适合发酵木质纤维素水解物的微生物细胞工厂。截止至2009 年为止,科学家们已经把重组后4 种菌株发酵木糖制备乙醇理论产率分别提升到了85%,94%,90%,95%,实际产率也都到达了40% 左右。
尼龙
在了解了生物基材料的平台化合物后,我们将目光转向它们的下游产品,即聚酯纤维、生物塑料、树脂材料和生物橡胶,这将是生物基材料大有所为的领域。在合成纤维工业,尼龙是具有里程碑意义的产品。自1935 年Wallace Carothers在杜邦公司研制出这种化学纤维后,合成纤维领域开始大放异彩。尼龙是聚酰胺纤维的统称,高聚物分子内含有重复的酰胺键,像极了生物大分子蛋白质的结构。通常人们利用二元胺与二元酸缩聚、己内酰胺开环聚合或者直接由单一氨基酸自聚得到不同性能的尼龙纤维。相比于其他所有纤维品类,尼龙具有极高的耐磨性,这使其成为应用至今的重要纤维品类。
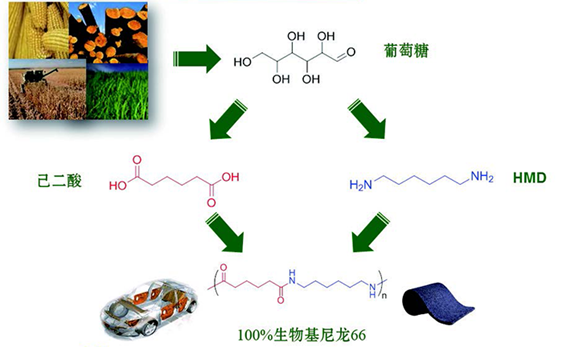
目前,尼龙生产的主要前体物质,即二元胺与二元酸,均来源于化石资源。既然已有研究工作改造微生物用以发酵生产这些聚合物单体,一个热切的想法是:生物基尼龙是不是很快就可以成为现实?事实亦是如此,利用大肠杆菌或谷氨酸棒状杆菌将赖氨酸转化为戊二胺、丁二胺的技术已经实现,二元酸的生产也能够在微生物体内完成,通过对发酵液进行分离回收,我们能够得到聚合物级别的二元胺和二元酸,从而完全实现生物基尼龙的生产(图1)。只要能够实现我们所感兴趣的聚合物单体的生物基生产,那么由生物基聚合物代替煤基、石油基聚合物的时代也将触手可及。
青蒿素
疟疾是一个全球性的健康问题, 据2010 年的数据显示,疟疾全球每年有2 亿的疟疾患者,每年有65.5 万人死于疟疾,尤其在非洲以及一些发展中国家中尤为严重。青蒿素是一种非常有效的抗疟疾药物,最开始是由中国科学家屠呦呦等人从黄花蒿(Artemisia annua)中分离得到。黄花蒿虽然在全球都有种植,但是其青蒿素含量具有明显的地域特性,只有我国局部地区的黄花蒿中青蒿素含量较高,青蒿素在黄花蒿中的含量一般在1% 以下(图2)。所以通过直接从黄花蒿中提取无法满足人们的需求。所以人们将目光转向了利用微生物细胞工厂来生产青蒿素。
青蒿素的合成主要涉及以下几步:法呢基焦磷酸(FPP)→青蒿二烯→青蒿酸→二氢青蒿酸→二氧青蒿酸过氧化物→青蒿素。2003 年,UC Berkeley 的Keasling 教授课题组将来自酵母的FPP 合成涉及的8个基因以及来自黄花蒿(Artemisia annuaL)的青蒿二烯合成酶基因ADS 引入到大肠杆菌中,构建出一个可以直接从葡萄糖,甘油等碳源直接生产青蒿素前体青蒿二烯(amorphadiene)的生产线,青蒿二烯的产量可以达到112.2 mg/L。但是这样的产量还是远远不能够满足工业化的需求。而且从青蒿二烯还需要经过好几步转化才能得到青蒿素。
2006 年,Keasling 教授课题组在青蒿二烯合成的基础上又往前走了一大步:他们采用酿酒酵母为底盘宿主,优化了已有的FPP 合成的生产线,同时引入了来自黄花蒿的三个基因:ADS基因,细胞色素单加氧酶CYP71AV1基因以及其还原伴侣基因CPR1,这样就得到了一个可以直接生产青蒿酸(artemisinic acid)的细胞工厂。该细胞工厂可以提供100mg/L 青蒿酸产量。依然,该产量距离青蒿素的工业化生产还有
一定的距离。
直到2013 年,经过近7 年的进一步努力,Keasling 教授课题组终于取得了突破性的进展。他们进一步从黄花蒿中识别出三个针对青蒿酸合成的关键基因:细胞色素b5基因CYB5, 醇脱氢酶ADH1 基因,青蒿醛脱氢酶ALDH1 基因进一步引入到酵母中,通过优化匹配之后,成功构建了生产青蒿酸的细胞工厂。该细胞工厂在发酵时,青蒿酸的产量达到了惊人的25g/L。Keasling 等人利用该合成的青蒿酸再次经过化学反应最终实现了青蒿素高效,低成本的合成。同年4月份,法国诺菲(Sanofi)制药公司根据Keasling 等人的研究,当即启动了大规模的青蒿素部分合成。

